ANCA関連血管炎の基礎病態
以下の論文をまとめます。
ANCA関連血管炎の基礎病態はじめに
ANCA関連血管炎(ANCA-associated vasculitis: AAV)は,血漿中の抗好中球細胞質抗体(anti-neutrophil cytoplasmic antibody: ANCA)の出現とともに, 全身の小型血管炎を発症する自己免疫疾患である.
AAVの種類
- MPA (microscopic polyangiitis) : 顕微鏡的多発血管炎
- GPA (granulomatosis with polyangiitis) : 多発血管炎性肉芽腫症
- EGPA (eosinophilic granulomatosis with polyangiitis) : 好酸球性多発血管炎性肉芽腫症
- 薬剤関連AAV
MPA (microscopic polyangiitis) : 顕微鏡的多発血管炎
MPO(myeloperoxidase)-ANCAの出現とともに,糸球体をはじめ全身の小型血管に壊死性血管炎を発症する. 70歳台をピークとする高齢者に好発し,急速進行性腎障害を呈する.
皮膚白血球破砕性血管炎や肺毛細血管炎を認めることもある.本邦のMPAでは,欧米に比べて間質性肺炎を併発する頻度が高いことが指摘されている.
GPA (granulomatosis with polyangiitis) : 多発血管炎性肉芽腫症
鼻,眼,耳,上気道および肺の壊死性肉芽腫,全身の小型血管の壊死性肉芽腫性血管炎,半月体形成性壊死性糸球体腎炎を臨床病理学的な特徴とする疾患で, 1939年にWegenerにより報告された.
EGPA (eosinophilic granulomatosis with polyangiitis) : 好酸球性多発血管炎性肉芽腫症
臨床的に気管支喘息が先行し,末梢血の好酸球数増加を背景として,好酸球浸潤を伴う壊死性血管炎,血管外肉芽腫を発症する血管炎で, 1951年にChurgとStraussにより報告された.
血管炎は全身臓器に起こりうるが,心臓,肺,肝臓,消化管,腎臓,皮膚などが比較的好発部位である.
薬剤関連AAV
薬剤関連AAVは血管炎全体の3%程度とされ,一般に軽症である.多くはMPAに類似した発熱,倦怠感,関節痛,筋肉痛などの全身症状, 皮疹や末梢神経障害などを呈する.これらの症状が出現するまでに,2~3年と比較的長期間薬剤を使用した後に発症するのが特徴である.
多くの場合,薬剤の中止によって症状は軽快するが,多臓器が障害された場合や薬剤の中止が遅れた場合には重症化することがある.
原因薬剤としては,抗甲状腺薬のプロピルチオウラシル(propylthiouracil: PTU)が最も多く報告されており,PTUを使用している患者の約30%がANCA陽性となる.
AAVの基礎病態
好中球のプライミング
病原性微生物の生体内への侵入を感知した樹状細胞は,Th17細胞を誘導・刺激し,IL-17を産生させる. IL-17はマクロファージからのTNF-αやIL-1βといった炎症性サイトカイン産生を介して好中球を活性化する。 好中球が活性化の準備段階に入ることをプライミングという。
プライミングされた好中球へのANCAの結合
活性化された好中球の細胞表面にはMPOやPR3といったANCA抗原が表出する.血漿中にANCAが存在すると, 好中球細胞膜に表出したANCA抗原に対してANCAが結合する.それと同時に,ANCAのFc部分が好中球細胞膜上のFc受容体に結合する.
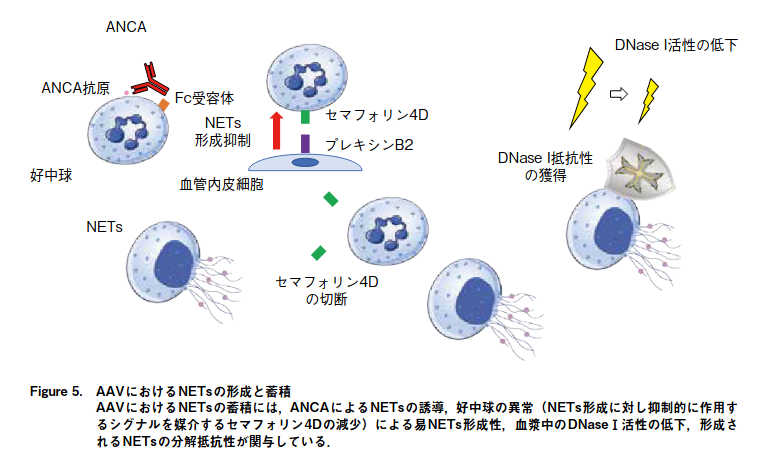
ANCAの結合による好中球の過剰な活性化とNETsの形成
ANCAの結合により好中球の過剰な活性化が生じ,炎症性サイトカインや蛋白分解酵素,活性酸素種(reactive oxygen species: ROS)の放出が誘導され, 最終的に血管内皮細胞の傷害を引き起こす.この他,ANCAにより誘導されるNETsも血管内皮傷害に寄与している.
NETs(neutrophil extracellular trap)は活性化した好中球が細胞外に放出するDNA線維である.
NETs形成を含む活性化好中球による血管内皮傷害とNETsの除去障害
NETsは生体防御に不可欠な自然免疫機構であるが,過剰なNETsは血管内皮傷害の原因ともなるため,血漿中のDNase Ⅰによる分解制御を受けている. しかしながら,MPA患者では血漿中のDNase Ⅰ活性が低下していることが明らかになっている.
組織中に沈着するNETsがDNase Ⅰによって分解されず,生体内に残存すると,NETsに含まれるMPOなどの好中球細胞質蛋白が自己抗原となり, ANCA産生の原因となる.すなわち,AAVでは,ANCAがNETsを誘導し, NETsがANCAの 産 生 原 因 と な るANCA-NETs悪 循 環(ANCA-NETs vicious cycle)が病態形成に深く関わって おり,それには好中球の易NETs形成性,血漿中のDNaseⅠ活性の低下,形成されるNETsの分解抵抗性が寄与している.
NETsを標的としたAAVの新規治療戦略
好中球のプライミング阻害
AAVの病態形成において重要な役割を果たすNETsの形成には,ANCAが結合するMPOなどの抗原が好中球細胞質内から細胞膜上に移動するプライミングの過程が不可欠である. 好中球のプライミングに関わるC5aの受容体に結合し,好中球細胞膜上のC5a受容体へのC5a結合に拮抗するアバコパンが,AAVの病態を改善する.
プライミングされた好中球へのANCAの結合阻害
プライミングされた好中球にANCAが結合する際,ANCAのFc部分が好中球細胞膜上のFc受容体に結合する. 免疫グロブリン製剤は好中球細胞膜上のFc受容体をマスクすることにより,この結合を阻害する可能性がある.
ANCAの結合による好中球の過剰な活性化とNETsの形成阻害
ANCAの結合により引き起こされる好中球の過剰な活性化を抑制する戦略として, Fc受容体からのシグナルを伝達する脾臓チロシンキナーゼ(spleen tyrosine kinase:Syk)やブルトン型チロシンキナーゼ(Bruton’s tyrosine kinase: Btk)の阻害, NETs形成過程において重要な役割を果たしているROSやPAD,NEをはじめとするセリンプロテアーゼの阻害などが考案され,前臨床段階にある.
NETs形成を含む活性化好中球による血管内皮傷害とNETsの除去障害回避
Watanabe-Kusunokiらはトロンボモジュリンが活性化好中球による血管内皮細胞傷害に対して抑制的に働き,AAVモデルの病態を改善させたと報告している.
著者らは,AAVの病変局所においてNETsにDNase Ⅰ分解抵抗性を付与している分子を同定し,その分子の作用を阻害することでNETsの制御不全を解消できると考え, 同分子の特定を目指している.NETsは生体防御に不可欠であり,NETsの形成を抑制することは少なからず免疫低下につながるが, この方法であれば生理的NETs形成には影響を与えないため,薬剤による続発性免疫低下を回避できると考えている.
おわりに
AAVは高齢者に好発し,急速進行性腎障害を呈することが多く,重篤な場合には肺出血や脳出血などを来して死亡することもある難治性疾患である.
読んでみて
内容が高度すぎてほとんど理解できません。
最近、「MPA (microscopic polyangiitis) : 顕微鏡的多発血管炎」と診断された患者さんを外来で診察しました。
腹痛で来院したのですが、理学的所見の割に炎症所見だけが亢進していました。憩室炎と診断したのですが腎機能障害が進行性であり他科紹介にてそのように診断されました。